
La actividad enzimática se puede inhibir, es decir, reducir o eliminar la actividad enzimática o catalítica de enzimas específicas.
La inhibición puede ser:
Irreversible - el inhibidor se une covalentemente a la enzima, casi siempre a un grupo de la cadena lateral de los amino ácidos en el foco activo. La enzima queda inactiva permanentemente.
Por ejemplo, la aspirina o ácido acetilsalicílico (ASA) inhíbe irreversiblemente la acción de la sintetasa de prostaglandina:

Algunas prostaglandinas producen dolor e inflamación. Al quedar bloqueada su síntesis se reduce la inflamación y se alivia el dolor.
Reversible: el inhibidor puede disociarse de la enzima porque no se une por enlaces covalentes. Esta inhibición puede ser competitiva o no-competitiva.
(a)Inhibición Competitiva - el inhibidor competitivo es muy similar al sustrato normal de la enzima. Dada esa similitud estructural, este tipo de inhibidor se une reversiblemente al foco activo de la enzima.

El inhibidor forma un complejo enzima-inhibidor equivalente al complejo enzima-sustrato:

Como hay un equilibrio, entonces la rapidez de ambas reacciones se iguala:
R1 = R-1
por lo que:
k1[ E ][ I ] = k-1[ EI ]
de aquí que:

donde KI es la constante de disociación de EI (o constante de inhibición). Esta constante se usa para describir cuán fuerte se une el inhibidor a la enzima.
De acuerdo a esta expresión,
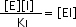
por lo que [ EI ] es directamente proporcional a [ I ] e inversamente proporcional a KI.
O sea, a mayor valor de KI , más débil la unión del inhibidor con la enzima, el complejo EI se disocia fácilmente, y el foco activo vacante puede estar disponible para unirse a su sustrato.
No hay reacción productiva mientras el inhibidor se une a la enzima,por lo que la actividad de la enzima declina.
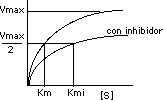
El efecto del inhibidor competitivo en la actividad enzimática se revierte por un aumento en la concentración del sustrato: a altas concentraciones todos los focos activos se combinan con el sustrato y la actividad enzimática se normaliza.
La Vmax se mantiene constante con o sin inhibidor competitivo. Sin embargo, cuando está presente el inhibidor Km aumenta y Vmax nunca se alcanza:
Por la gráfica de Lineweaver Burk observamos que, como la inhibición competitiva no afecta la Vmax: el intercepto en "y" (1/Vmax) es identico para todas las posibles concentraciones del inhibidor competitivo; todas la líneas intersectan el el mismo punto en el eje de "y":

A baja [S] ([S] <<Km), la enzima está predominantemente en la forma libre, E. El inhibidor competitivo puede combinarse con E, por lo que la presencia del inhibidor disminuye la rapidez cuando [S] es baja. A estas condiciones la expresión de rapidez es:
Como la rapidez inicial es proporcional a Vmax/Km, la presencia del inhibidor afecta la pendiente de la línea de la gráfica de Lineweaver-Burke, que es precisamente el recíproco de Vmax/Km,o sea,(Km/Vmax). El valor de la pendiente aumenta. También hay un aumento en Km según aumenta [ I ].
Aumentando [ I ] causa un aumento en Km/Vmax. Por lo tanto, en la inhibición competitiva se afecta la pendiente pero no hay efecto en Vmax.
(b) Inhibición No-Competitiva: el inhibidor se combina con la enzima en un lugar distinto al foco activo. Tanto EI como EIS se forman:

La unión del inhibidor afecta la configuración tridimensional de la enzima y bloquea la reacción. Este tipo de inhibidor no compite directamente con el sustrato para unirse a la enzima (no afecta la unión ES), por lo tanto, este tipo de inhibición no es reversible cuando aumenta la concentración del sustrato.
Esta inhibición disminuye la Vmax según aumenta [ I ], pero no afecta Km (la enzima puede unirse al sustrato):
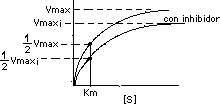
Esto implica que se afecta la pendiente Km/Vmax y el intercepto en "y" en la gráfica de Lineweaver Burk:
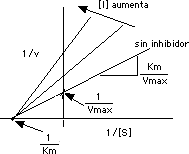
Las líneas de diferentes [ I ] intersectan en puntos distintos en "y". Sus pendientes son diferentes, pero es el mismo Km en todos los casos (intersectan el mismo punto en "x").
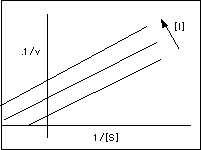
Inhibicion Incompetitiva: el inhibidor se combina sólo con ES (no con la enzima), por lo que el inhibidor ejerce su efecto sólo a altas concentraciones de sustrato en las que hay gran cantidad de complejo enzima-sustrato (ES). Por lo tanto, variando la [S] no afecta o evita la unión con el inhibidor. Por otro lado, es evidente que el sustrato y el inhibidor se combinan con la enzima en lugares diferentes.

A bien baja concentración de sustrato ( [S]--->0), la enzima está libre (E). Como el inhibidor no se combina con E, éste no afecta la velocidad, asi como tampoco la pendiente Km/Vmax, por lo que las pendientes son independientes de la concentración del inhibidor. Sólo se afectan los interceptos en "y" (1/Vmax) y en "x" (-1/Km) . Como resultado se obtienen una serie de líneas paralelas cuando se usan diferentes concentraciones del inhibidor.
Resumen:
Efecto cinético en reacción inhibida relativas a la reacción sin inhibir:
